Tensioattivi
Ultimo aggiornamento 14/01/2024
Le questioni che riguardano i “tensioattivi” sono tra gli argomenti più vasti e complessi per un neofita che si approccia al mondo della cosmesi. In questa pagina cercherò di fare una panoramica su cosa sono i tensioattivi e come si usano, in modo da fissare alcuni punti fermi su cui poi poter approfondire l’argomento.
- Cos’è un tensioattivo?
- La tensione interfacciale
- Come agiscono i tensioattivi
- Classi di tensioattivi e usi
- Meccanismo di detersione
Cos’è un tensioattivo?
Con il termine “tensioattivo” si indica qualsiasi sostanza chimica in grado di ridurre la tensione interfacciale di un fluido.
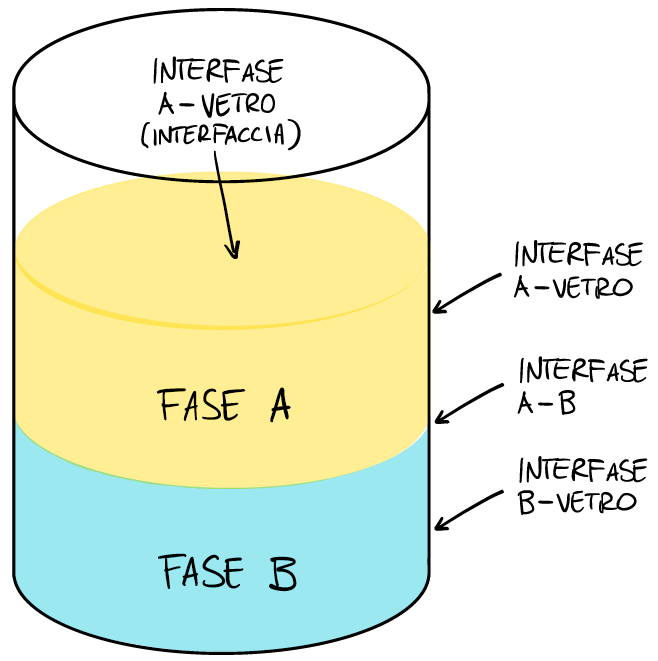
In chimica, una fase non è altro che una porzione di materia chimicamente e fisicamente omogenea. Semplificando, una fase è un materiale che non si mescola spontaneamente con gli altre. Per esempio, in un bicchiere contenente acqua e olio, sono presenti quattro fasi: acqua, olio, vetro e aria.
La superficie che separa due fasi diverse prende il nome tecnico di interfase. Quando ci si riferisce all’interfase tra un liquido e l’aria si parla spesso di interfaccia, da cui il termine “interfacciale”. Nel nostro bicchiere le interfasi sono quattro: olio/acqua, olio/aria, acqua/vetro e olio/vetro.
Questo può sembrare un discorso superfluo, ma capire come funzionano le interazioni tra fasi è indispensabile per capire il fenomeno della tensione interfacciale e quindi il funzionamento dei tensioattivi.
La tensione interfacciale
Se andiamo virtualmente a zoomare l’immagine del bicchiere, possiamo analizzare come si dispongono le molecole che compongono le diverse fasi. Nell’immagine sotto sono rappresentate le interfasi acqua/vetro e acqua/aria.
In blu sono rappresentate le molecole di acqua. Le molecole che si trovano all’interno del liquido sono circondate da tutti i lati da altre molecole di acqua: tutte le molecole sono quindi attratte tra di loro in modo omogeneo. All’interfase, le molecole blu non sono circondate solo da altre molecole blu, ma si trovano a contatto anche con molecole di vetro (nero) e di aria (azzurro). Siccome l’acqua (polare) non ama interagire con vetro e aria (apolari), queste molecole all’interfase legano le loro vicine con con una forza maggiore rispetto a quella delle loro cugine che si trovano all’interno del liquido. Questa forza è la tensione interfacciale.
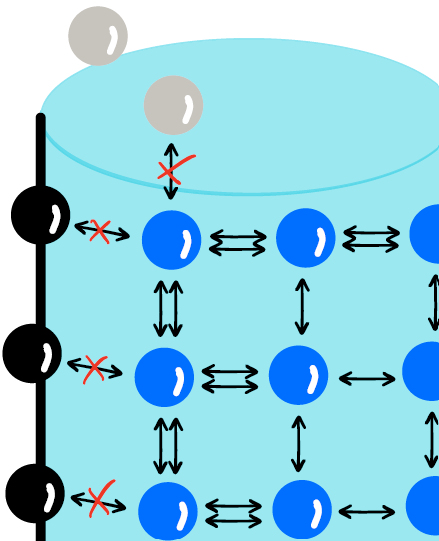
La tensione interfacciale o superficiale è una forza di un liquido che si crea all’interfaccia tra due fasi. Si manifesta quando la forza di coesione delle molecole che compongono una fase sono maggiori rispetto alle forze di adesione tra due fasi diverse.
Questa forza è la stessa che permette alle gocce d’acqua di avere una forma rotonda, o di far camminare sulla superficie di un lago insetti leggeri come le zanzare. Quando ci si riferisce all’interfaccia aria/acqua, si parla maggiormente di tensione superficiale anziché interfacciale, ma il concetto è lo stesso.
La tensione interfacciale è una proprietà del fluido e non dell’interfaccia. Si misura in dynes/cm2 e non è uguale per tutti i fluidi, ma dipende dalle loro caratteristiche chimiche. Maggiore è la capacità del fluido di creare legami intermolecolari (dipolo-dipolo, H-bonds, VdW), più grande sarà la forza tra molecole e quindi la tensione interfacciale. Detto in termini scientifici, la tensione interfacciale di un fluido è elevata quando le forze coesive tra le sue molecole superano le forze adesive tra molecole di fasi diverse.
Come agiscono i tensioattivi
I tensioattivi sono molecole bifunzionali: presentano una testa polare (idrofilica) e una coda apolare (idrofobica), legate covalentemente. La loro struttura particolare le rende in grado di interagire sia con sostanze polari che apolari, contemporaneamente. Questo li rende particolarmente utili nella chimica delle interfasi, per ridurre la tensione interfacciale delle fasi di un sistema.

Nel caso del nostro bicchiere, se sciogliamo del tensioattivo in acqua, le sue molecole sono in grado di posizionarsi all’interfaccia acqua/vetro e acqua/aria, rompendo le forze di coesione tra molecole di acqua e quindi riducendo la tensione della fase acquosa.
Questo dona all’acqua diverse proprietà a seconda dell’interfaccia considerata:
- acqua/vetro: migliore bagnatura del vetro di cui è composto il bicchiere,
- acqua/aria: miscelazione ed emulsionatura di aria e acqua (formazione della schiuma),
- acqua/olio: miscelazione ed emulsionatura di acqua e olio.
Le molecole di tensioattivo agiscono contemporaneamente su tutte le interfacce che trovano, ma alcune caratteristiche peculiari li rendono più utili in certe applicazioni piuttosto che su altre. Solubilità, ripartizione, flessibilità, stabilità al pH, rapidità, elasticità, aggressività, sostantività sono solo alcune delle proprietà dei tensioattivi, che ne influenzano l’usabilità. Purtroppo, la chimica dei tensioattivi è piuttosto complessa e gli ambiti di applicazione di queste molecole sono tantissimi, per cui non è possibile fare un riassunto esaustivo.