
Tensioattivi
Ultimo aggiornamento 11/06/2020

Le questioni che riguardano i “tensioattivi” sono tra gli argomenti più vasti e complessi per un neofita che si approccia al mondo della cosmesi. In questa pagina cercherò di fare una panoramica su cosa sono i tensioattivi e come si usano, in modo da fissare alcuni punti fermi su cui poi poter approfondire l’argomento.
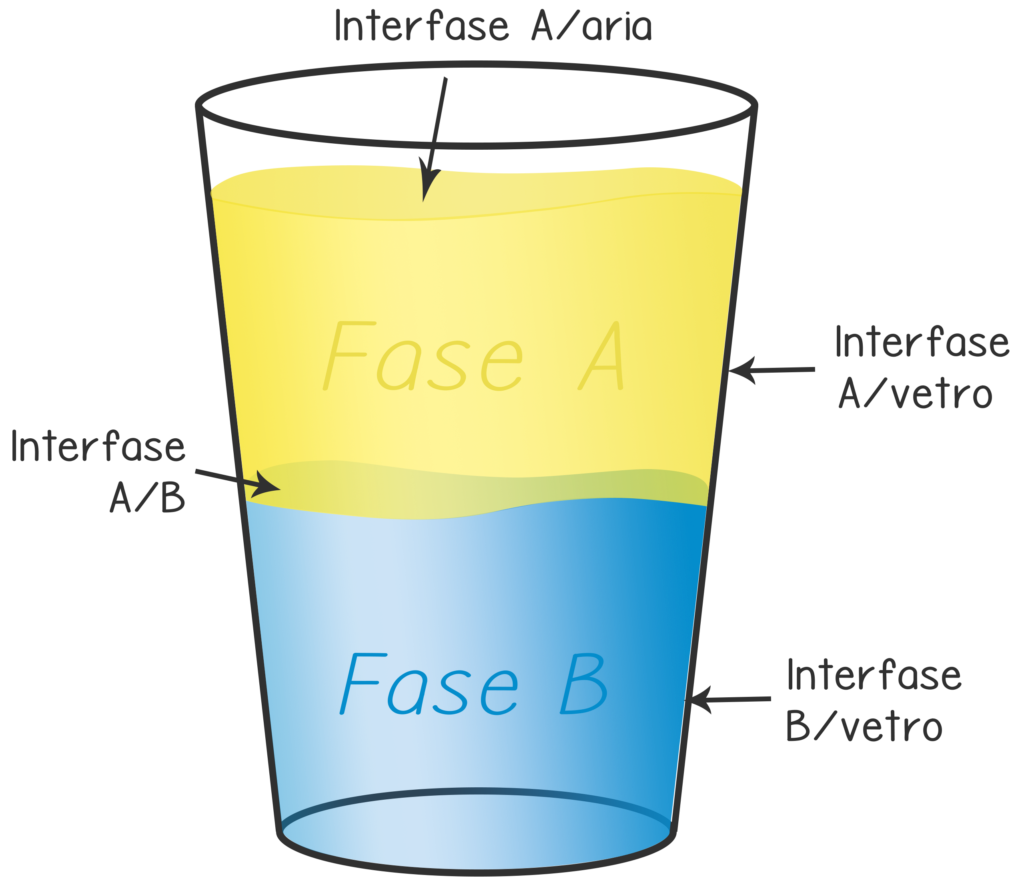
Per prima cosa, è necessario specificare che con il termine “tensioattivo” si indica qualsiasi sostanza chimica in grado di modificare la tensione interfacciale tra due fasi. Una fase non è altro che una porzione di sistema caratterizzata da stato fisico e composizione chimica uniformi. La superficie che separa due fasi diverse prende il nome tecnico di interfase.
Per esempio, se il nostro sistema è un bicchiere con acqua e olio, saremo in presenza di quattro fasi: la fase acquosa, la fase oleosa, il vetro e l’aria. Le interfasi saranno anch’esse quattro: interfase olio/acqua, interfase olio/aria, interfase acqua/vetro e interfase olio/vetro.
Questo può sembrare un discorso superfluo, ma capire come funzionano le interazioni tra fasi è indispensabile per capire il fenomeno della tensione superficiale o interfacciale che si manifesta in tutte le interfasi.
Se andiamo virtualmente a zoomare l’immagine del bicchiere, possiamo analizzare come si dispongono le molecole che compongono le diverse fasi. Le molecole di acqua (in blu) che si trovano al centro del liquido attraggono tutte le altre molecole che lo circondano in modo omogeneo. Al contrario, le molecole che si trovano all’interfase non trovano solo molecole di acqua da attrarre, quindi legano le loro simili a disposizione con una forza maggiore. Questa forza in superficie è la tensione interfacciale.
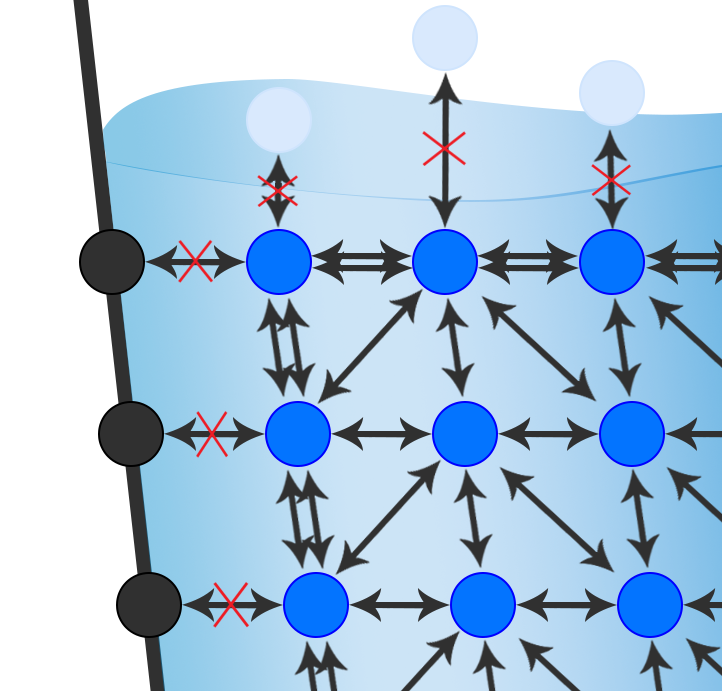
La tensione superficiale o interfacciale è una forza che si crea all’interfaccia tra due fasi. Si manifesta quando le molecole che compongono ciascuna fase hanno una forza di coesione maggiore nei confronti di molecole identiche rispetto a molecole della fase opposta.
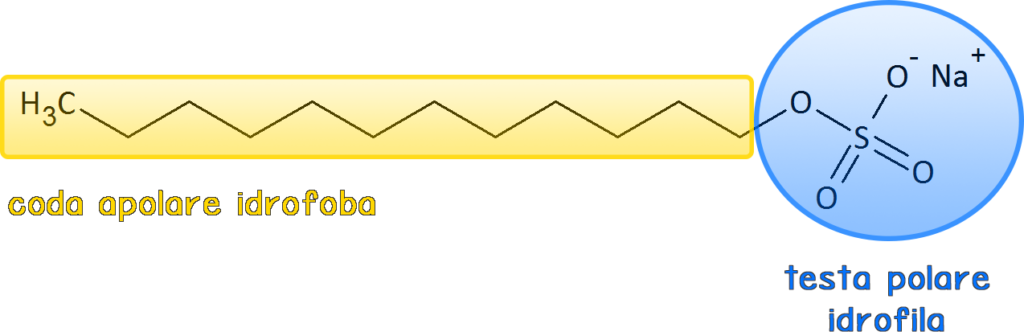
I tensioattivi sono molecole bifunzionali: presentano una testa polare (idrofilica) e una coda apolare (idrofobica). Questa loro caratteristica gli permette di interagire contemporaneamente con le molecole di acqua e altri liquidi/superfici. In poche parole, possiamo dire che i tensioattivi sono in grado di posizionarsi all’interfase in modo da ridurre le forze di coesione tra molecole. In pratica, nei nostri esempi, possono rendere più facile bagnare il bicchiere o mescolare l’acqua con l’olio.
Un tensioattivo quindi può agire all’interfase tra due fasi liquide immiscibili (es. olio e acqua) oppure all’interfase tra una fase liquida e una solida (es. acqua e pelle). Nel primo caso il tensioattivo agisce da emulsionante, nel secondo da detergente.
Quindi possiamo iniziare la nostra discussione distinguendo i tensioattivi in:
- tensioattivi emulsionanti: funzione tecnica per strutturare il cosmetico
- tensioattivi detergenti: funzione pratica, per la detersione della persona
Questo ci aiuta a capire che tutti gli emulsionanti sono tensioattivi, ma non tutti i tensioattivi sono emulsionanti. In questa pagina tratteremo solo dei tensioattivi detergenti, per quanto riguarda gli emulsionanti rimando alla pagina dedicata.
 Tensioattivi detergenti
Tensioattivi detergenti
Ma perchè i detergenti lavano?
La risposta a questa domanda è semplice quanto poco scontata: perchè lo sporco è principalmente grasso. Quando noi mettiamo la pelle a contatto con del sapone, stiamo abbassando la tensione interfacciale tra l’acqua e la pelle. I tensioattivi si dispongono all’interfase con le teste polari verso l’acqua e le code apolari verso il grasso della pelle. L’azione meccanica della strofinatura aiuta a rimuovere i detriti ancorati al sapone.

A causa della loro doppia natura chimica, i tensioattivi non stanno ben volentieri in una delle due fasi, ma tendono a disporsi proprio all’interfase dove possono esporre la parte idrofila all’acqua e la parte lipofila alle fasi lipofile, o comunque meno polari dell’acqua.
Se però la concentrazione di tensioattivo aumenta e termina lo spazio all’interfase, cosa succede?

I tensioattivi a questo punto si distribuiscono cercando di ridurre il più possibile il contatto delle code idrofobiche con l’acqua, con cui non interagiscono volentieri. Si formano delle strutture indicate nella figura qui a fianco con il numero 4, che si chiamano micelle. Sebbene per semplicità si disegnino in 2D, le micelle sono tridimensionali; dovete immaginarle come delle sfere di tensioattivo formate da teste polari disposte vicine tra loro. La quantità di tensioattivo che serve per far formare le micelle si chiama “concentrazione micellare critica” o CMC.